Caso del mes Febrero 2026
« Todos los casos
Caso del mes Febrero 2026
Descripción
Autores
- Victoria Esteban Izquierdo
- Enrique Marco de Lucas
Hospital Universitario Marqués de Valdecilla, Santander.
Mail: victoriae@sescam.jccm.es
Historia Clínica
Varón de 85 años que acude a urgencias tras ser encontrado en la cama con palidez, desviación ocular y secreción sanguinolenta en la comisura bucal. Afebril, sin otra clínica acompañante. Se solicitan pruebas complementarias orientadas a crisis comicial con episodio postcrítico.
Leyendas
Imagen:

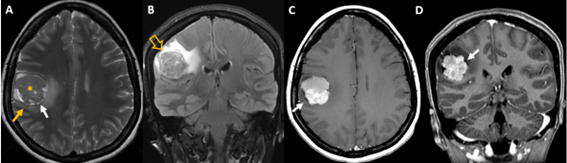
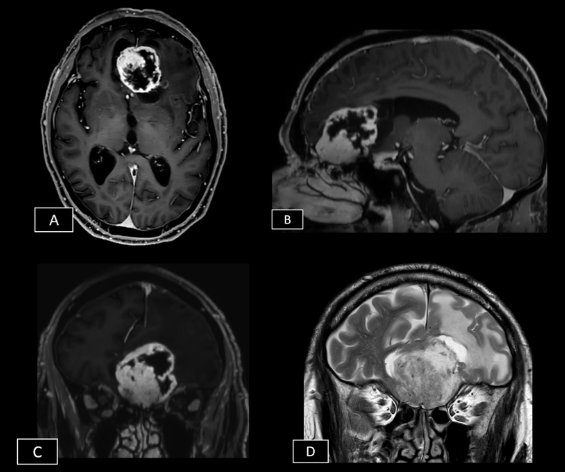
Resonancia magnética: secuencias ponderadas en T1 con gadolinio en plano axial (A), sagital (B) y coronal (C): Masa extraaxial de aspecto heterogéneo, bien definida, con un intenso realce periférico, de 42 x 41 x 38 mm (AP x TR x CC) en la línea media frontobasal. La lesión está en contacto con la lámina cribiforme y parece originarse del bulbo y tracto olfatorio izquierdo. Aisladas formaciones quísticas periféricas. Secuencia ponderada en T2 plano coronal (D): extensa área de hiperseñal T2 que se extiende por la sustancia blanca del lóbulo frontal izquierdo.
Diagnóstico
Según la OMS, los schwannomas son tumores benignos derivados de las células de Schwann. Son tumores extremadamente raros, representando aproximadamente el 7 % de los tumores intracraneales. La edad media de presentación es 20 – 50 años.
Las manifestaciones clínicas más frecuentes son anosmia, cefalea y convulsiones.
La RM es la técnica de elección para su diagnóstico, mostrando una masa extraaxial bien delimitada, de intensidad baja o intermedia en imágenes ponderadas en T1 e hiperintensas en T2. La hiperintensidad en T2 puede ser homogénea o mostrar un aspecto “en diana” con alta intensidad en la periferia de la lesión.
El diagnóstico diferencial debe incluirse con otros tumores extraaxiales con realce de localización subfrontal en la fosa anterior, que incluyen meningioma, adenoma quístico y, en raras ocasiones, estesioneuroblastoma. El schwannoma del bulbo o tracto olfativo es excepcional. Adicionalmente, se debe realizar el diagnóstico diferencial con los tumores intraaxiales (incluyendo el glioblastoma IDH wildtype).
Debido a su naturaleza benigna, el tratamiento es quirúrgico sin necesidad de adyuvancia. El pronóstico después de una resección total es favorable.
Evolución del caso: el paciente fue sometido a craneotomía bifrontal y exéresis de la lesión. El estudio anatomopatológico con inmunohistoquímica mostró SOX10 y S100 positivas, confirmando schwannoma del nervio olfatorio grado 1 de la OMS (CNS WHO 2021).
Bibliografía:
- M. Besharatirad, G. Sharifi, F. Bidari Zerehpoosh, An Olfactory Schwannoma mimicking esthesioneuroblastoma: A Case Report, Interdisciplinary Neurosurgery: Advanced Techniques and Case Management. Volume 21,2020 Mar, 100726.
- Kim DY, Yoon PH, Kie JH, Yang KH. The olfactory groove schwannoma attached to the cribriform plate: a case report. Brain Tumor Res Treat. 2015 Apr;3(1):56-9.
- Martínez-Soto, L., Alfaro-Baca, R., Torrecilla-Sardón, M.V., Fernández-Vallejo, B., Ferreira-Muñóz, R., & Diego, T. De. (2009). Un nuevo caso de «schwannoma del olfatorio»: presentación y revisión de la literatura. Neurocirugía, 20(3), 294-297.